
Tevagrastim® : Tout savoir sur le biosimilaire du filgrastim de Teva Santé
Les informations essentielles :
Molécule : filgrastim
Médicament de référence : NEUPOGEN®
Faisant partie d’un groupe biosimilaire substituable en pharmacie : Oui
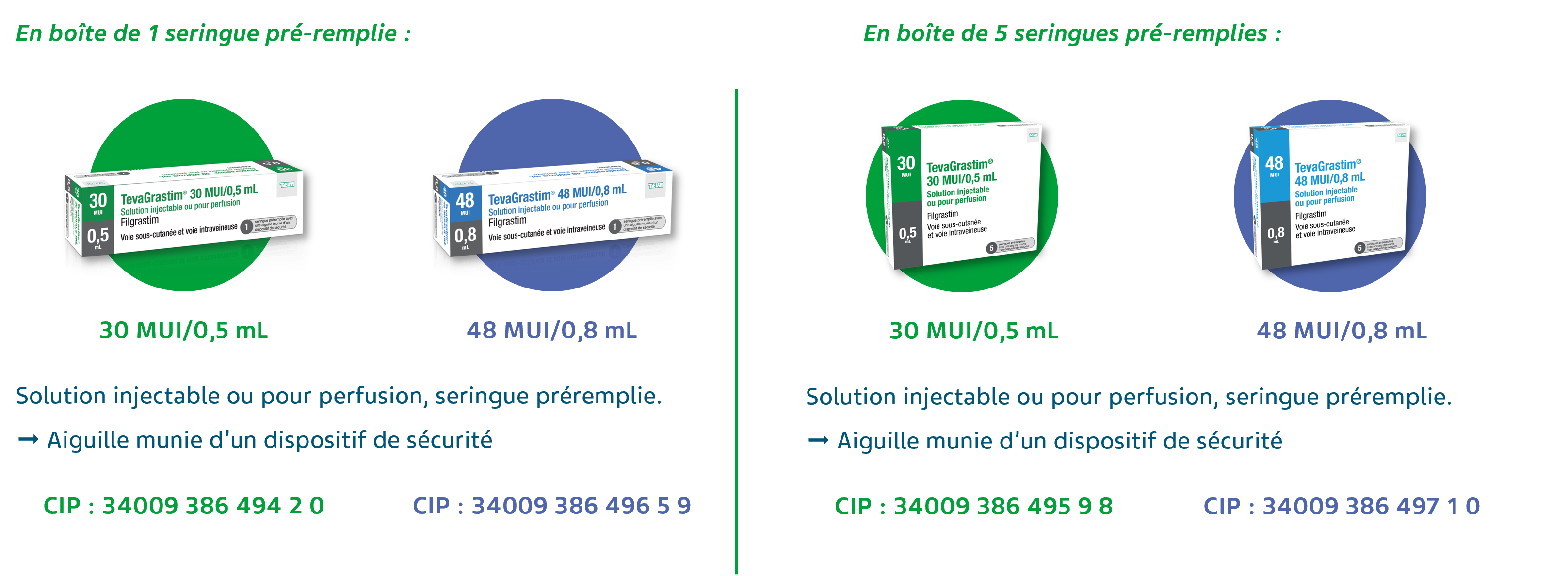
Que contient la boîte de TevaGrastim®1 ?
TevaGrastim® est disponible1 :
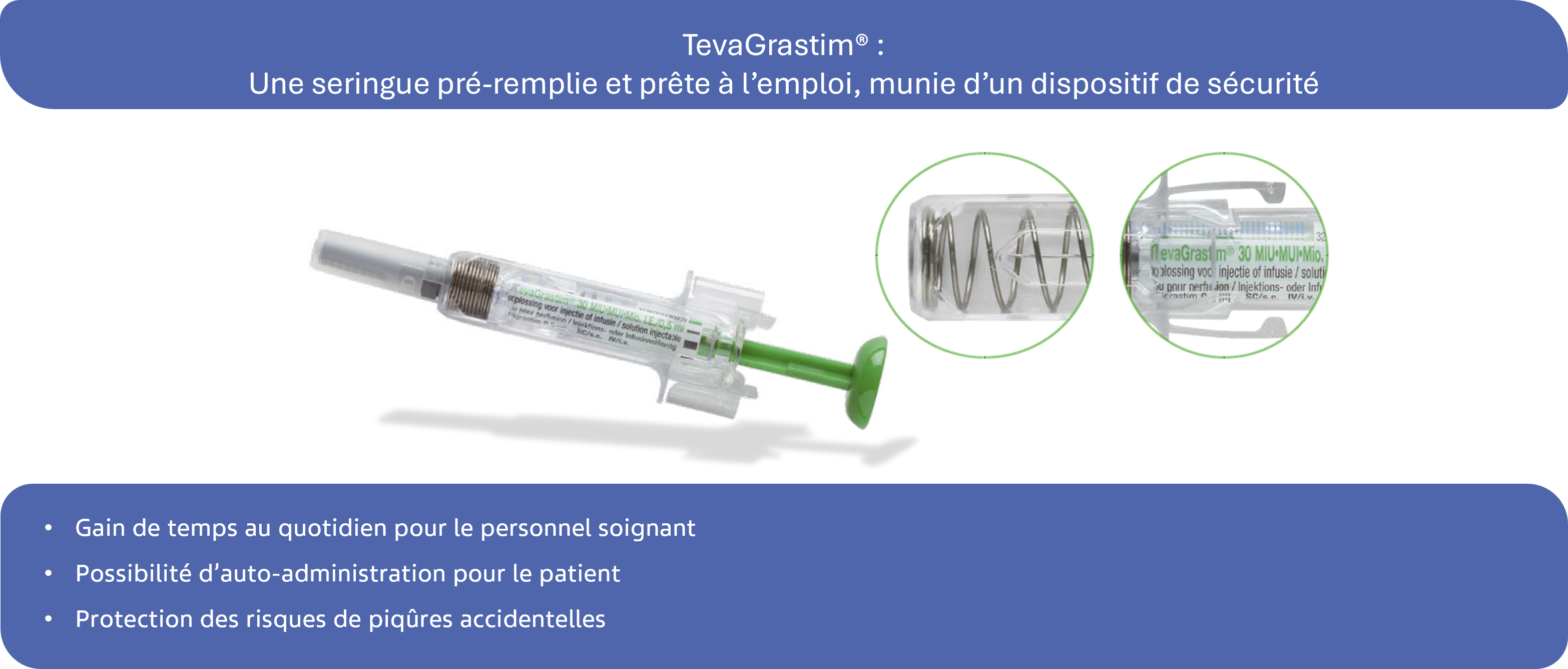
A propos de la seringue TevaGrastim®1 :
Conditions de conservation1 :

Devenir des seringues sorties du réfrigérateur:
- Période unique ≤ 4 jours, à une température ≤ 25°C
➞ S’il n’est pas utilisé, le produit peut être replacé au réfrigérateur jusqu’à la date de péremption. - Période > 4 jours, à une température > 8°C
➞ Les seringues devront être éliminées.
Les conditions de délivrance et de substitution :
Les conditions de prescription :
Pour être délivré en pharmacie, l’ensemble des informations suivantes concernant la prescription de TevaGrastim® doivent apparaître sur l’ordonnance2 :

Les conditions de substitution :
En cas de substitution, celle-ci devra s’accompagner des modalités suivantes de dispensation3,4 :
- Information du patient, par le prescripteur, de la possibilité de substitution par le pharmacien du médicament biologique prescrit
- Information du patient, par le pharmacien lors de la dispensation, de la substitution effective et des informations utiles pour le patient suite à cette substitution, dont le rappel des règles de conservation de la spécialité dispensée
- Mention sur l’ordonnance du nom du médicament effectivement dispensé par le pharmacien
- Information du prescripteur par le pharmacien quant au médicament dispensé
- Enregistrement par le pharmacien du nom du médicament délivré par substitution et son numéro de lot par tous moyens adaptés afin de mettre en œuvre la traçabilité requise pour tous les médicaments biologiques
- Continuité de la dispensation du même médicament lors des dispensations suivantes
Quelques données complémentaires sur TevaGrastim® :

Pour commander TevaGrastim® :
|
Auprès de votre grossiste |
Auprès de votre délégué pharmaceutique Teva Santé |
|
Auprès du service client Teva Santé
|
Sur la plateforme MonTeva
|
|
Indications et place dans la stratégie thérapeutique1,7 :TevaGrastim® est indiqué dans :
Conditions de prescription et de délivrance7 :
Plan de gestion des risques1 :TevaGrastim® fait l’objet d’un plan de gestion des risques (PGR). |
Déclarez immédiatement tout effet indésirable suspecté d’être dû à un médicament à votre Centre Régional de Pharmacovigilance (CRPV) ou sur https://signalement.social-sante.gouv.fr/
|
Pour une information complète, consultez le Résumé des Caractéristiques du Produit sur la base de données publique du médicament : https://base-donnees-publique.medicaments.gouv.fr
|
Références:
1. Résumé des Caractéristiques du Produit et Notice TevaGrastim® en vigueur. 2. Code de la Santé Publique. Article R5132-3. Modifié par Décret n°2020-120 du 13 février 2020 - art. 10. 3. Article 64 de la Loi n°2021-1754 de Financement de la Sécurité Sociale pour 2022 (LFSS 22) publiée au Journal Officiel du 24 décembre 2021. 4. Arrêté du 20 février 2025 fixant la liste des groupes biologiques similaires substituables par le pharmacien d’officine et les conditions de substitution et d’information du prescripteur et du patient telles que prévues au 2°de l’article L. 5125-23-2 du code de la santé publique, publié au Journal Officiel du 27 février 2025 5. EPAR TevaGrastim® (publié le 29 septembre 2008). 6. Del Giglio A et al. XM02 is superior to placebo and equivalent to Neupogen® in reducing the duration of severe neutropenia and the incidence of febrile neutropenia in cycle 1 in breast cancer patients receiving docetaxel/doxorubicin chemotherapy. BMC Cancer 2008;12:332 (étude retenue lors de l’évaluation de l’AMM). 7. Avis de la Commission de la Transparence de TevaGrastim® du 01/07/2015 et du 20/02/2019.
TGRAS-FR-00031– Visa n°24/10/60583187/PM/001– Octobre 2024

